一、目的要求
瞭解過氧化物酶的作用,掌握愈創木酚法測定果蔬組織中過氧化物酶活性的方法。
二、基本原理
過氧化物酶(Peroxidase,POD)是果蔬體內普遍存在的一種重要的氧化還原酶,它與果蔬的許多生理過程和生化代謝過程都有密切關系。在果蔬的生長發育、成熟衰老過程、抗病、抗氧化、抗逆境脅迫中,POD活性不斷發生變化。在受到外界刺激、病原菌侵染、貯藏環境變化、加工條件改變等作用時,果蔬組織中POD酶活性都會做出相應得應答反應。
過氧化物酶催化過氧化氫(H2O2)氧化酚類物質產生醌類化合物。這些化合物進一步縮合或與其它分子縮合形成顏色較深的化合物。在過氧化物酶催化作用下,過氧化氫能將愈創木酚(鄰甲氧基苯酚)氧化形成4-鄰甲氧基苯酚。該產物呈紅棕色,在470 nm處有最大光吸收,故可通比色法測定過氧化物酶的活性。
三、材料、儀器及試劑
(一)材料
各種水果和蔬菜。
(二)儀器及用具
研缽、高速冷凍離心機、分光光度計、秒表、移液器、離心管、試管、容量瓶(100 mL,1 000 mL)。
(三)試劑
1.100 mmol/L、pH 5.5醋酸緩沖液
母液A(200 mmol/L醋酸溶液):量取11.55 mL冰醋酸,加蒸餾水稀釋至1 000 mL。
母液B(200 mmol/L醋酸鈉溶液):稱取16.4 g無水醋酸鈉(或稱取27.2 g三水合乙酸鈉),用蒸餾水溶解、定容至1 000 mL。
取68 mL母液A和432 mL母液B混合後,調節pH至5.5,加蒸餾水稀釋至1 000 mL。
2.50 mmol/L、pH 5.5醋酸緩沖液
3.提取緩沖液(含1 mM PEG、4% PVPP和1% Triton X-100)
稱取340 mg PEG 6000(聚乙二醇6000)、4 g PVPP(聚乙烯吡咯烷酮,Polyvinyl–polypyrrolidone),取1 mL Triton X-100,用100 mmol/L、pH 5.5醋酸緩沖液溶解、稀釋至100 mL。
4.25 mmol/L愈創木酚溶液
取320 μL愈創木酚,用50 mmol/L、pH 5.5醋酸緩沖液稀釋至100 mL。
5.0.5 mol/L H2O2
取1.42 mL 30% H2O2溶液(30% H2O2的摩爾濃度約為17.6 mol/L),用50 mmol/L、pH 5.5醋酸緩沖液稀釋至50 mL,現用現配,避光保存。
四、實驗步驟
(一)酶液制備
稱取5.0 g果蔬組織樣品,置於研缽中,加入5.0 mL提取緩沖液,在冰浴條件下研磨成勻漿,於4℃、12 000×g離心30 min,收集上清液即為酶提取液,低溫保存備用。
(二)活性測定
取一支試管,加入3.0 mL 25 mmol/L愈創木酚溶液和0.5 mL酶提取液,再加入200 μL 0.5 mol/L H2O2溶液迅速混合啟動反應,同時立即開始計時。將反應混合液倒入比色杯中,置於分光光度計樣品室中。以蒸餾水為參比,在反應15 s時開始記錄反應體系在波長470 nm處吸光度值作為初始值,然後每隔1 min 記錄一次,連續測定,至少獲取6個點的數據。重復三次。
五、實驗結果與計算
1.將測定的數據填入下表
2.計算結果
記錄反應體系在470 nm處的吸光度值,制作OD470值隨時間變化曲線,根據曲線的初始線性部分計算每分鐘吸光度變化值△OD470。然後,以每克鮮重(FW)果蔬樣品每分鐘吸光度變化值增加1時為1個過氧化物酶活性單位(U),則U =△OD470·min-1·g-1 FW。計算公式:
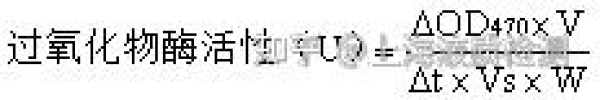
式中:
△OD470——反應混合液的吸光度變化值;
△t ——酶促反應時間,min;
V ——樣品提取液總體積,mL;
Vs——測定時所取樣品提取液體積,mL;
W ——樣品重量,g。
過氧化物酶活性還可以每分鐘反應體系在波長470 nm處吸光度值讀數變化增加1時所需的酶量為1個活性單位(U),表示為U = △OD470·min-1·mg-1蛋白質。酶提取液中蛋白質含量可利用考馬斯亮藍染色法進行測定。即:
其中,C表示酶提取液中蛋白質含量(mg/mL)。這裡所計算的實際上是酶的比活力,有利於減少操作過程帶來的誤差。
六、註意事項
1.應進行預實驗。測定每一分鐘反應體系的吸光度值的變化,確定該酶促反應速度呈線性變化(初級反應)的時間段。這樣,隻測定某一段時間內反應液的初始吸光度值(OD0)和最終值(ODt)這兩個數據,就可以計算每分鐘吸光度值的變化量。
2.利用100 mmol/L、pH 6.0磷酸緩沖液作為提取液,可以提取多數果蔬組織中過氧化物酶。配制方法:
母液A:0.2 mol/L Na2HPO4 溶液(53.65 g Na2HPO4·7H2O或71.64 g Na2HPO4·12H2O配成1000 mL)。
母液B:0.2 mol/L NaH2PO4 溶液(27.6 g NaH2PO4·H2O或31.2 g NaH2PO4·2H2O配成1000 mL)。
分別取12.3 mL母液A與87.7 mL母液B充分混勻,調節pH值,稀釋至200 mL。樣品提取液中的其它成分根據需要加入。
3.在提取緩沖液中加入PEG,PVPP和Triton X-100等是為瞭提高酶蛋白的溶解性,減少提取過程中酶活性的損失。這些物質的具體作用可以參閱本書第一篇相關內容。