15.9 Oxoacids of nitrogen 氮的含氧酸
15.9.1 H_2N_2O_2 的異構體
[N_2O_2]^{2-} 鈉鹽的水溶液可以由有機亞硝酸鹽通過15.109反應制備,或用鈉汞齊還原亞硝酸鈉制成。 Ag^+ 的加入導致瞭 Ag_2N_2O_2 的沉淀。用無水氯化氫在幹燥的乙醚中處理這種鹽,可以形成低二硝酸, H_2N_2O_2 。
遊離的 H_2N_2O_2 是一種弱酸。它具有潛在的爆炸性,可以自發地分解成一氧化二氮和水。離子 [N_2O_2]^{2-} 以反式和順式兩種形式存在。其反式構型在動力學上更為穩定。用氣態一氧化二氮加熱固體氧化鈉,可以得到順式的 Na_2N_2O_2 。 H_2N_2O_2 的光譜數據也顯示瞭一個反式構型(結構15.51)。在2,2'-聯吡啶鹽中,O····H—N的氫鍵將形成於 [N_2O_2]^{2-} 陰離子的O原子與2,2'-聯吡啶陽離子(15.52)之間,導致固態鏈的形成。
酸與硝基氨基甲酸鉀的反應導致一種低亞硝酸的異構體的生成(反應15.110)。硝胺的結構表征;硝基N原子是平面三角,氨基N原子是三角錐體。該化合物具有潛在的爆炸性,並經過堿催化分解為一氧化二氮和水。
15.9.2 亞硝酸
亞硝酸隻存在於溶液和氣相中。後者的結構為15.53。它是一種弱酸,但對於溶液中的歧化是不穩定(反應15.111)。它可以通過15.112反應原位制備,選擇水溶性試劑以給予不溶性金屬鹽(硫酸鋇)作為產物。AgNO2不溶於水,但其他金屬亞硝酸鹽可溶於水。
亞硝酸鈉是制備重氮類化合物的重要試劑,如原位制備亞硝酸的反應15.113。堿金屬硝酸鹽在單獨加熱或與Pb更好的加熱時產生亞硝酸鹽(反應15.114)。
亞硝酸可以被酸化高錳酸根等強氧化劑氧化為硝酸鹽。亞硝酸還原的產物取決於還原劑:
- 碘離子和亞鐵離子還原:生成NO;
- 錫(II)離子還原:生成氧化二氮;
- 二氧化硫還原:生成羥胺;
- 鋅的堿性溶液還原:生成氨。
在稀釋溶液中,亞硝酸,而不是硝酸,將碘離子氧化為碘單質,這說明瞭該反應是受動力學控制,而不是熱力學控制。公式15.115表明,這些氧化還原反應的電極電勢相似;亞硝酸比稀硝酸更快,而不是更強的氧化劑。
15.9.3 硝酸及其衍生物
硝酸是一種重要的工業化學品,在Ostwald工藝中大規模生產,這與合成氨工藝密切相關。第一步是將氨氧化成NO。冷卻後,NO與空氣混合,並被水的逆流吸收。所涉及的反應總結在方案15.116中。這產生的硝酸濃度約為60%,通過蒸餾可以濃縮到68%。
在實驗室中,可以通過在硝酸鉀中加入硫酸,然後真空蒸餾產品,制成純硝酸。它是一種無色的液體,但必須儲存在273K以下,以防止輕微的分解(反應15.117)。這使酸呈黃色。普通濃縮硝酸是含68%硝酸的共沸物,在393K處沸點。光化學分解反應為15.117。由於發煙的硝酸中存在過量的二氧化氮,所以是橙色的。
在水溶液中,硝酸作為一種強酸,溶解大多數金屬,如果存在微量的亞硝酸,通常會更快(動力學有利)。例外情況是金和鉑族金屬;鐵和鉻被濃硝酸鈍化。
錫、砷和一些d區金屬在硝酸處理後轉化為氧化物,但其他的形成硝酸鹽。隻有Mg、Mn和Zn從非常稀的硝酸中釋放出氫氣。如果金屬是比H2更強的還原劑,與硝酸反應將酸還原為N2、氨、羥胺或一氧化二氮。其他金屬釋放出NO或二氧化氮(例如,反應15.118和15.119)。
目前已知有大量的金屬硝酸鹽。第IA族金屬離子、 Sr^{2+} 、 Ba^{2+} 、 Ag^+ 和 Pb^{2+} 的無水硝酸鹽很容易獲得,但對於其他金屬,無水硝酸鹽通常使用四氧化二氮制備。用濃硝酸和磷(V)氧化物對相應的水合鹽進行緩慢脫水,制備無水的 Mn(NO_3)_2 和 Co(NO_3)_2 ,說明瞭一種替代的合成策略。所有金屬的硝酸鹽和陽離子,包括銨根離子,都可溶於水。堿金屬硝酸鹽在加熱後分解為亞硝酸鹽(反應15.120;反應15.114)。硝酸銨的分解取決於溫度。大多數金屬硝酸鹽在加熱後會分解為氧化物,但銀和汞(II)硝酸鹽給予各自的金屬(反應15.122)
許多有機和無機化合物被濃硝酸氧化,盡管水溶液中的硝酸鹽離子通常是一種非常緩慢的氧化劑(見上文)。當區域內含有足量的氯氣和亞硝酰氯時,硝酸可以和Au(反應15.123)、Pt反應,形成氯化物配合物。
濃硝酸將 I_2 、 P_4 和 S_8 分別氧化為 HIO_3 、磷酸和硫酸。
硝酸的分子結構如圖15.17a所示。NO鍵距離的差異很容易理解的共振結構顯示。硝酸鹽離子具有平面三角形(D3h)結構,其化學鍵的等價性可以用價鍵或分子軌道理論進行合理化。
用氟氣處理稀硝酸或硝酸鉀,硝酸中的氫原子可以被氟取代。該產品,硝酸氟,結構見圖15.54,是一種爆炸性氣體,與水反應緩慢,但與堿水溶液反應迅速(反應15.124).
硝酸鈉與氧化鈉在570K下反應生成 Na_3NO_4 (正硝酸鈉), K_3NO_4 也可以制備類似。X射線衍射數據證實, [NO_4]^{3-} 離子是四面體,N-O鍵長為139pm,符合單鍵特征。結構15.55包括鍵合的價鍵圖。遊離酸 H_3NO_4 尚不清楚。
15.10 Oxides of phosphorus, arsenic, antimony and bismuth 磷、砷、銻、鉍的氧化物
從P到Bi的第VA族元素分別形成兩種氧化物, E_2O_3 (或 E_4O_6 )和 E_2O_5 (或 E_4O_{10} ),後者隨同族由上至下變得不那麼穩定:
- E_2O_5 (E=P、As、Sb、Bi)是酸性的;
- P_4O_6 是酸性的;
- As_4O_6 和 Sb_4O_6 是兩性的;
- Bi_2O_3 是堿性的。
15.10.1 磷氧化物
磷(III)氧化物,三氧化二磷,是通過在有限的氧氣供應中燃燒白磷而獲得的。它是一種無色的揮發性固體(mp=297K,bp=447K),分子結構為15.56。P-O鍵的距離(165pm)與單鍵一致,P-O-P和O-P-O的角度分別為128°和99°。該氧化物可溶於乙醚或苯,但會與冷水發生反應(反應15.125).
三氧化二磷中的每個P原子都攜帶一對單獨的電子,因此三氧化二磷可以作為一個Lewis堿基。一種和兩種硼烷等價物的加合物有報道,但三氧化二磷與 Me_2Scdot BH_3 反應,然後在244K甲苯溶液中緩慢結晶,得到 P_8O_{12}(BH_3)_2 (15.57)而不是三氧化二磷的加合物。固態結構證實瞭三氧化二磷的二聚化是通過結構15.56中的P-O鍵裂解和單體單元之間的P-O鍵重組而發生的。迄今為止,遊離的 P_8O_{12} 尚未被分離出來。
三氧化二磷與氧氣的氧化得到五氧化二磷,而臭氧氧化導致 P_4O_{18} 的形成(反應15.126)。每個P原子的正方形錐體環境與 (RO)_3PO_3 中發現的錐體環境有關(見圖16.5)。在溶液中, P_4O_{18} 在238K以上分解,氧氣逐漸釋放,但幹 P_4O_{18} 粉末的分解具有爆炸性。

磷中最重要的氧化物是五氧化二磷。它可以直接由磷單質與氧氣反應得到,或通過氧化三氧化二磷制得。在氣相中,磷(V)氧化物含有結構為15.58的五氧化二磷分子;P-O橋和P-O端鍵長度分別為160和140pm。當蒸汽迅速凝結時,得到一個具有揮發性且極吸濕的固體,其中也含有五氧化二磷分子。如果該固體在一個封閉的容器中加熱數小時,而熔體在被允許冷卻前保持在一個高溫下,則得到的固體是大分子的。在普通壓力和溫度下存在三種多態形式,基本結構單元為單元15.59。在每個多型中,四個O原子中隻有三個通過POP橋連接磷酸鹽單元。磷(V)氧化物對水有很好的親和力。15.127),並且是第15.11節中描述的各種氧酸的酸酐。它常被用作幹燥劑。
其他三種磷氧化物, P_4O_7 (15.60)、 P_4O_8 (15.61)和 P_4O_9 (15.62),其結構與三氧化二磷和五氧化二磷的氧化物有關。
這些氧化物是混合的P(III)、P(V)物種,每個中心都帶有一個末端的含氧基團為P(V)。例如, P_4O_8 是通過在710K的密封管中加熱三氧化二磷而制成的,另一種產品是紅磷(反應15.128)。
15.10.2 砷、銻、鉍的氧化物
As和Sb的正常燃燒產物為As(III)和Sb(III)氧化物。每種氧化物的蒸汽和高溫固體多態物包含在結構上與15.56相關的 E_4O_6 (E=As或Sb)分子。低溫多態體具有包含三角錐體As或Sb原子的層結構。在520K以上的 As_4O_6 蒸汽的凝結導致瞭三氧化二砷玻璃體的形成。氧化砷(III)是砷化學中一個重要的前體,在工業上由硫化物制成。三氧化二砷在水中的溶解產生瞭一個非常弱的酸性溶液,並且所存在的物種很可能是 As(OH)_3 (亞砷酸),盡管這從未被分離出來。 As(OH)_3 水溶液的結晶得到三氧化二砷。砷(III)氧化物溶解在堿水中,得到含有 [AsO_2]^- 離子的鹽,在鹽酸水中形成 AsCl_3 。 Sb_2O_3 在水和水堿或鹽酸中的性質與三氧化二砷相似。
鉍(III)氧化物以鉍華的形式自然產生,在鉍單質加熱時與氧氣結合時形成。與第VA族的前面成員相比, Bi_2O_3 沒有觀察到分子物種,其結構更像是典型的金屬氧化物。
砷(V)氧化物最容易通過15.129反應比直接氧化元素。該路線利用瞭 As_2O_5 是砷酸的酸酐。在固態下, As_2O_5 具有由As-O-As連接的八面體 AsO_6 和四面體 AsO_4 單元組成的三維結構。
銻(V)氧化物可以通過 Sb_2O_3 在高溫和壓力下與氧氣反應而產生。它結晶為一個三維結構,其中Sb原子相對於六個O原子是八面體的位置。鉍(V)氧化物的特征很差,它的形成需要強氧化劑(如堿性次氯酸鹽)對 Bi_2O_3 的作用。
15.11 Oxoacids of phosphorus 磷的含氧酸
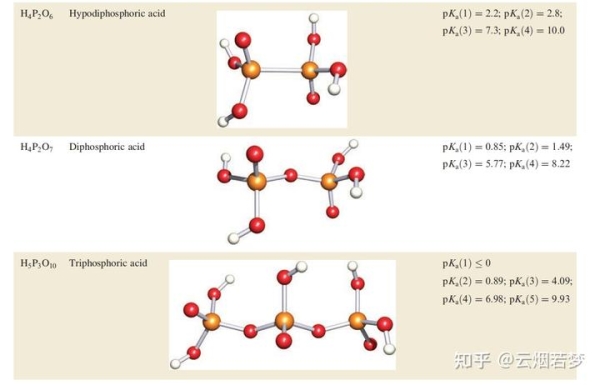
15.11.1 次磷酸 H_3PO_2
白磷與堿水溶液的反應產生次磷酸一氫鹽離子 [H_2PO_2]^- 。以氫氧化鋇為堿,將Ba離子沉淀為硫酸鋇,蒸發水溶液,得到白色的 H_3PO_2 晶體。在水溶液中, H_3PO_2 是一種相當強的一元酸(反應15.130)。
磷酸及其鹽類是還原劑。 NaH_2PO_2cdot H_2O 在工業上用於非電化學還原過程,它將Ni(II)還原為Ni,並將鎳鍍在上面,例如鋼上。所謂的非化學鎳塗層也含有磷,而磷的含量會影響塗層的腐蝕和耐磨性能。例如,P含量高(11-13%)的塗層具有更強的耐酸腐蝕性,而將P含量降低到<4%則使塗層更耐堿腐蝕。
當加熱時, H_3PO_2 按式15.131的兩個反應式不成比例的自由組合。產物由反應溫度決定。
在磷酸中,一個質子到末端O原子的分子內轉移產生一個互變異構體,其中P原子為3配位:
[W_3(OH_2)_9NiSe_4{PH(OH)_2}]^{4+} 的結構如下:
P、橙色,W、銀色,鎳、綠色,硒、棕色,O、紅色,H、白色。
15.11.2 亞磷酸 H_3PO_3
亞磷酸可以從加入三氧化二磷的冰水溶液中結晶。純亞磷酸形成無色的、靜止的晶體(mp343K),在固態下,酸的分子通過氫鍵連接形成一個三維網絡。在水溶液中,它是二堿基的。(反應15.132和15.133)。
亞磷酸加熱歧化:
15.11.3 次焦磷酸 H_4P_2O_6
紅磷與次氯酸鈉或 NaClO_2 的反應得到 Na_2H_2P_2O_6 。它可以在水溶液中轉化為遊離酸的二水合物,化學式為 [H_3O]_2[H_2P_2O_6] 。使用五氧化二磷脫水得到 H_4P_2O_6 。P-P鍵存在的第一個跡象來自於觀察酸是抗磁的,鹽 [NH_4]_2[H_2P_2O_6] 的X射線衍射數據證實瞭這一結構特征。所有四個末端P-O鍵的長度都相等(157pm),圖15.63中的鍵合描述與這一觀察結果一致。與我們在第15.3節中對高價物種的評論一致,這種描述比一對共振結構更合適,每個共振結構涉及一個P=O和一個P-O鍵。酸在熱力學上對歧化反應是不穩定的,反應15.135在水溶液中是緩慢發生的。因此, H_4P_2O_6 不能通過還原磷酸或在水介質中氧化亞磷酸來產生。因此,需要使用已經存在磷鍵的前體(即元素磷)
15.11.4 磷酸及其衍生物
磷酸是由磷酸巖制成的(反應15.136),或通過五氧化二磷的水合作用(反應15.127)。
純磷酸形成可分解的、無色的晶體(mp=315K)。在晶體狀態下,廣泛的氫鍵將磷酸分子連接成一個層狀網絡。在站立時,結晶性的磷酸迅速形成粘性液體。在這個和商業上85%(重量與水)的酸中,廣泛的氫鍵是酸的糖漿性質(黏性)的原因。
磷酸非常穩定,除瞭在非常高的溫度下沒有氧化性能。磷酸水溶液是一種三堿性酸(表15.7),可以分離出含有磷酸二氫鹽、磷酸一氫鹽和磷酸鹽。因此,在適當的pH條件下,可以制備三種Na鹽。兩種最常見的鈉鹽和鉀鹽是磷酸氫二鈉和磷酸一氫鉀。磷酸鈉被廣泛用於緩沖水溶液,而磷酸三正丁酯是從水溶液中提取金屬離子的一種有價值的溶劑。
當磷酸在510K下加熱時,它被脫水為焦磷酸(反應15.137)。比較這些酸的結構表明,水被消除,並伴隨著P-O-P橋的形成。進一步加熱產生三磷酸(反應15.138)。
最簡單的縮聚磷酸 H_4P_2O_7 在298K下是固體,可以從反應15.137或以更純的形式通過反應15.141得到。它是一種比磷酸更強的酸。
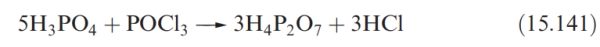
鈉鹽 Na_4P_2O_7 是通過在510K加熱磷酸氫二鈉得到的。在水溶液中,焦磷酸根非常緩慢地水解成磷酸根,這兩個離子可以通過化學測試來區分,例如添加Ag離子沉淀白色的焦磷酸銀或淡黃色的磷酸銀。
被稱為“偏磷酸”的酸實際上是一種聚合酸的粘性混合物,通過在600K加熱磷酸和焦磷酸獲得。人們更瞭解這些酸的鹽,而不是酸本身。例如, Na_3P_3O_9 可以通過在870-910K加熱磷酸二氫鈉,並保持熔體在770K使水蒸氣逸出來分離,從而分離。它含有環狀的三聚離子(圖15.19a)。在堿性溶液中, [P_3O_9]^{3-} 水解成 [P_3O_{10}]^{5 -} (三磷酸離子,圖15.19b)。鹽 Na_5P_3O_{10} 和 K_5P_3O_{10} (以及幾種水合物)得到瞭很好的表征, Na_5P_3O_{10} (通過反應15.142制造)用於洗滌劑,它作為水軟化劑。然而,擔心廢水中的磷酸鹽與湖泊和河流的富營養化有關,這是用沸石取代洗滌劑中的磷酸鹽的原因。多聚磷酸鹽可以作為隔離劑使用。母酸 H_5P_3O_{10} 還沒有以純形式制備,但溶液滴定可以確定pKa值。
鹽 Na_4P_4O_{12} 可以通過用磷酸在670K下加熱,並緩慢冷卻熔體來制備鹽 Na_4P_4O_{12} 。或者,五氧化二磷的揮發性形式可以用氫氧化鈉冰水溶液和碳酸氫鈉處理。圖15.19c為該酸根離子的結構,其中 P_4O_4 環采用椅式構象。 [P_6O_{18}]^{6-} 離子的幾種鹽(圖15.19d)也被很好地表征瞭;Na鹽是通過在1000K下加熱磷酸二氫鈉而制成的。
上面的討論說明瞭磷酸氫二鈉或磷酸二氫鈉加熱條件的變化如何導致產品的變化。需要仔細控制的條件來獲得長鏈多聚磷酸鹽。根據 PO_{4} 單元的相對方向,可以做幾種修飾。交聯的聚磷酸鹽(其中一些是玻璃)可以通過用五氧化二磷加熱磷酸二氫鈉來制成。
15.11.5 手性磷酸陰離子
盡管存在八面體離子( [Sb(OH)_6]^- ),但尚未分離出類似的含磷陰離子。然而,含有螯合O,O'-供體配體的相關陰離子是已知的,我們在這裡介紹它們的立體選擇性應用。例如,陰離子15.67,它具有D3對稱性,且為手性(圖15.20)。這個傢族的陰離子的重要性在於它們能夠區分手性陽離子。
15.12 Oxoacids of arsenic, antimony and bismuth 砷、銻、鉍的含氧酸
“亞砷酸”(As(OH)3或H3AsO3)尚未被分離出來。三氧化二砷的水溶液可能含有H3AsO3,但金屬亞砷酸鹽(如M3AsO3,其中M=Ag或堿金屬)是已知的。雖然幾乎沒有證據表明存在公式為As(O)OH的酸,但已知[AsO2]-鹽的存在。亞砷酸鈉,NaAsO2(市售),包含Na離子和無限鏈15.68,三角錐體As(III)中心。
砷酸是通過將As2O5溶解在水中或用硝酸氧化三氧化二砷而得到的(反應15.129)。砷酸的酸性強度與磷酸相似。在適當的條件下,可以制備出從砷酸中提取的含有 [AsO_4]^{3-} 、 [HAsO _4]^{2-} 或 [H_2AsO_4]^- 離子的鹽。在酸性溶液中,砷酸作為一種氧化劑,易於氧化或還原的pH值依賴性可以通過半方程15.143來理解。
濃聚砷酸鹽離子在水解(即切割As-O-As橋)方面的動力學穩定性比濃聚磷酸鹽離子要低得多,而且在水溶液中隻存在單體 [AsO_4]^{3-} 。因此,在360K下,通過使 NaH_2AsO_4 脫水,可以得到 Na_2H_2As_2O_7 。進一步脫水(410K)得到 Na_3H_2As_3O_{10} ,在500K下形成聚合物 (NaAsO_3)_n 。在固態下,後者包含由As-O-As橋連接的四面體AsO4單元鏈。所有這些濃縮的砷酸鹽在加水後都會還原為砷酸根。
Sb(III)的草酸鹽不穩定,很少有銻礦鹽具有很好的表征。金屬銻酸鹽包括 NaSbO_2 ,它可以由 Sb_2O_3 和氫氧化鈉水溶液制備為三水合物;無水鹽具有聚合結構。目前不知道Sb(V)的含氧酸,也沒有四面體陰離子“ [SbO_4]^{3-} ”。然而,可以獲得明確定義的銻,例如,通過將銻(V)氧化物溶解在堿水中並使產品結晶。一些銻含有八面體 [Sb(OH)_6]^- 離子,例如 Na[Sb(OH)_6] 和 [Mg(OH_2)_6][Sb(OH)_6]_2 。其餘的銻應視為混合金屬氧化物。它們的固態結構由三維陣列組成,其中Sb(V)中心由六個O原子八面體配位,並由Sb-O-Sb橋連接,如 NaSbO_3 、 FeSbO_4 、 ZnSb_2O_6 和 FeSb_2O_6 (圖15.21)。
雖然有些鉍酸鹽的特征很好,但目前還不知道鉍中的氧酸。鉍酸鈉是一種不溶性的橙色固體,通過Bi2O3與空氣中的氫氧化鈉或過氧化鈉融合獲得。它是一種非常強的氧化劑,例如,在酸的存在下,它將Mn(II)氧化為高錳酸根,並從鹽酸中釋放出氯氣。像銻酸鹽一樣,一些鉍酸鹽最好被認為是混合金屬氧化物。
15.13 Phosphazenes 磷氮烯(磷腈)
磷氮烯是一組具有鏈狀或環狀結構的P(V)/N(III)化合物,是假設的N≡PR2的低聚物。五氯化磷與氯化銨在氯化溶劑(如氯苯)中的反應得到瞭式 (NPCl_2)_n 的無色固體的混合物,其中優勢物種的n為3或4。化合物 (NPCl_2)_3 和 (NPCl_2)_4 在減壓蒸餾容易分離。雖然反應15.144總結瞭總體反應,反應機理比較復雜。有一些證據支持圖15.22中的方案,它說明瞭三聚體的形成。
反應15.144是傳統的制備方法 (NPCl_2)_3 ,但產率通常為50%.采用反應15.145可以獲得提高的收率。同樣,盡管這看起來很簡單,但反應途徑是復雜的, (NPCl_2)_3 的形成與Cl3P=NSiMe3的形成相競爭(反應15.146).通過保證二氯甲烷中五氯化磷對N(SiMe3)3的添加速度較慢,可以使(NPCl2)3的產量進行優化。如果在二氯甲烷中快速加入N(SiMe3)3到五氯化磷中,然後加入正己烷,則Cl3P=NSiMe3(磷腈聚合物的前驅體,見下文)的產率得到優化。