慢性痛是臨床上常見的慢性疾病,發病率居高不下,其反復發作、遷延難治的特性使患者長期備受折磨。近年來,慢性痛的機制研究雖然取得瞭長足的進展,但臨床治療依舊面臨巨大挑戰,傳統的鎮痛藥常因鎮痛效果不佳或毒副作用大而使用受限。因此,研發能有效控制疼痛、減少毒副作用的新型理想鎮痛藥仍是需要迫切解決的重大問題。
2022年2月,空軍軍醫大學基礎醫學院羅層教授和武勝昔教授團隊在國際知名期刊Nature Communications(IF=14.919)在線發表瞭題為“Presynaptic NMDARs on spinal nociceptor terminals state-dependently modulate synaptic transmission and pain”的研究論文。
課題組系列研究發現傷害性感受器敏化是疼痛持續慢性化的始動因素,其與脊髓背角神經元形成的第一級突觸——傷害性初級傳入突觸的可塑性改變是進一步驅動慢性疼痛進展的“放大器”。因此,深入探討脊髓背角傷害性初級傳入的突觸傳遞及可塑性改變的產生機制和編碼規律,揭示傷害性感受器上介導該突觸傳遞及可塑性改變的關鍵突觸前分子通路,有望從源頭上消除疼痛信號的放大效應,為慢性痛治療找到“源頭堵截”的最佳措施。
NMDA受體(N-甲基-D-天冬氨酸受體)作為重要的同步事件檢測器,在突觸可塑性改變和慢性痛中的重要作用不言而喻。然而,由於其廣泛分佈於中樞神經系統,臨床上NMDA受體拮抗劑作為鎮痛藥的應用卻因嚴重的中樞毒副作用而使用受限。研究報道外周傷害性感受器上還大量表達有NMDA受體,並在中樞突末梢大量分佈。相對於突觸後NMDA受體的大量研究,傷害性感受器中樞突末梢突觸前NMDA受體(PreNMDARs)在痛覺信息的突觸傳遞及可塑性改變乃至疼痛敏化中的功能卻鮮有報道,其主要原因在於傳統的藥理學方法難以特異性地幹預突觸前NMDA受體。實驗室利用從突觸前傷害感受器末端特異性敲除功能性NMDA受體主要亞基轉基因小鼠(SNS-NR1-/-小鼠),對傷害性感受器末梢與脊髓投射神經元之間的突觸前NMDA受體進行深入研究。研究發現,PreNMDARs以狀態依賴的方式調節突觸前可塑性變化。
在這篇文章中,作者利用在中腦導水管周圍灰質(PAG)區域註射DiI逆行標記脊髓背角I層投射神經元,全細胞膜片鉗記錄標記神經元,給予背根2 Hz 240 times條件刺激,可以在突觸後神經元被鉗制在-70 mV及應用MK801阻斷突觸後神經元NMDA受體的情況下,誘發突觸前長時程增強(presynaptic long-term potentiation,preLTP)。應用SNS-NR1-/-小鼠進一步證明,該preLTP主要由傷害性感受器PreNMDARs介導。
圖1 SNS-NR1-/-小鼠和NR1fl/fl小鼠脊髓I層神經元突觸前長時程增強(preLTP)及其突觸前機制分析
那麼,外源性NMDA作用於傷害性感受器PreNMDAR產生怎樣的作用呢?研究發現,在生理狀態下外源性給予NMDA(50μM,30 s)顯著抑制生理狀態NR1fl/fl動物脊髓背角初級傳入突觸的eEPSCs(誘發的興奮性突觸後電流)(圖2a-b),PPR分析進一步證明傷害性感受器末梢PreNMDARs的激活通過突觸前機制抑制瞭基礎狀態下的谷氨酸釋放。通過在動物單側足底註射完全弗氏佐劑(CFA)產生慢性炎性痛模型,進而研究病理狀態下PreNMDARs的作用,研究發現在病理狀態下,外源性NMDA(50μM,30 s)則明顯增強NR1fl/fl動物脊髓背角突觸eEPSCs(圖2e-f)。上述效果均在SNS-NR1-/-小鼠中被顯著阻斷。這一結果提示傷害性感受器PreNMDARs以狀態依賴性的方式調節突觸傳遞,在基礎狀態下抑制突觸傳遞,而在病理狀態下則易化突觸傳遞。
圖2外源性NMDA在基礎狀態下誘導C-eEPSCs的突觸前抑制,在病理態下誘導突觸前增強
為瞭進一步明確PreNMDARs對突觸前傳遞的狀態依賴性調節,作者進一步阻斷內源性PreNMDARs來研究不同狀態下的突觸傳遞。研究發現,應用AP5 (競爭性NMDA受體拮抗劑)阻斷PreNMDARs,在基礎狀態下導致C-eEPSC增強,而在病理狀態下則導致C-eEPSC減弱(圖3a-c)。以上結果通過mEPSCs(微小興奮性突觸後電流)實驗進一步證實,在基礎狀態下,灌流AP5可以增強mEPSCs的頻率;而在病理狀態下,則減弱mEPSCs的頻率(圖3f-i)。
圖3 AP5阻斷內源性PreNMDAR在基礎狀態下導致突觸增強,但在病理狀態下則導致突觸抑制
為瞭進一步驗證PreNMDARs在傷害感受器脊髓末梢的功能,實驗室通過在突觸前特異性表達Ca2+探針的方法研究PreNMDARs的功能。將含有Cre依賴的GCaMP6s的AAV2/8載體病毒註射到SNS-Cre和SNS-NR1–/–小鼠的DRG(背根神經節)中,在病毒註射4-6周後進行成像實驗。結果表明外源性給予NMDA通過激活PreNMDAR誘致傷害性感受器中樞突末梢突觸前鈣信號顯著增強。同樣,通過背根刺激也可以誘發突觸前的鈣信號增強,並且這種增強作用可以被AP5阻斷,通過SNS-NR1–/–動物研究,證明突觸前鈣信號的增強主要依賴於PreNMDARs(圖4)。

圖4 超分辨率鈣成像實驗顯示PreNMDARs在傷害感受器中樞突的功能性表達
那麼,為什麼傷害性感受器PreNMDARs在不同的狀態下對突觸可塑性產生不同的作用呢?實驗室研究發現,小電導Ca2+激活的K+(SK)通道參與PreNMDARs介導的基礎狀態下的突觸抑制。應用SK通道阻斷劑Apamin抑制SK通道,可以導致C-eEPSCs顯著增強,並且與外源性NMDA有協同作用。進一步應用轉基因動物發現SNS-NR1-/-小鼠的SK相關電流顯著降低。結合Western blot實驗聯合提示傷害性感受器突觸前SK2通道的激活參與瞭PreNMDAR在基礎狀態下的脊髓突觸前抑制作用。那麼,PreNMDAR又如何促進炎癥性疼痛狀態下的脊髓突觸傳遞呢?實驗室首先驗證瞭炎性痛狀態下NMDAR和SK2通道活性的變化。在CFA註射24小時後,與基礎狀態相比,NR1fl/fl小鼠DRG中的NMDARs NR1亞基磷酸化水平顯著上調。DRG神經元中的SK相關電流在CFA炎性痛小鼠中顯著減弱,SK2通道的表達水平顯著下調。
圖5 SK通道參與介導生理狀態下傷害性感受器PreNMDARs的突觸前抑制作用
那麼炎性痛後脊髓背角突觸前SK通道下調的可能原因是什麼?大量研究表明脊髓NMDA受體-NO-cGMP通路在突觸可塑性和慢性疼痛發展中發揮關鍵作用。據報道,cGMP依賴性蛋白激酶I(PKG-I)在傷害性初級感覺神經元中高表達。實驗室研究發現傷害性感受器的持續激活導致DRG中NMDARs-PKG-I信號通路的顯著激活。
圖6 傷害感受器的持續激活導致DRG中NMDARs-PKG-I信號級聯的快速激活
那麼,PKG-I介導PreNMDAR狀態依賴性改變的下遊潛在靶點是什麼?實驗室研究表明,CFA後BDNF(腦源性神經營養因子)顯著增高,這種效應在SNS-NR1-/-小鼠中顯著降低。並且結合Cre動物及AAV-DIO-BDNF-pHluorin系統檢測突觸前BDNF的釋放,研究發現,AP5可以顯著抑制NR1fl/fl小鼠的突觸前BDNF的釋放,並且SNS-NR1-/-小鼠突觸前BDNF的釋放顯著降低。
圖7傷害性感受器突觸前PKG-I-BDNF參與介導PreNMDARs的突觸前易化作用
為瞭進一步評估BDNF在病理狀態下對PreNMDARs介導的突觸增強作用,實驗室構建BDNF shRNA,應用Cre-loxp技術將BDNF shRNA註射入L3背根神經節中,研究表明,在敲減傷害性感受器BDNF後,外源性NMDA介導CFA後的C-eEPSCs增強被顯著抑制。
圖8傷害性感受器突觸前BDNF調控易化PreNMDARs的功能
進一步行為學研究顯示,與NR1fl/fl小鼠相比,辣椒素誘導的繼發性痛敏在SNS-NR1-/-小鼠顯著降低。實驗室構建瞭Cre依賴的AAV2/8表達flag標簽的NR1 cDNA進行挽救實驗,將病毒註射入小鼠DRG表達,與SNS-cre小鼠相比,SNS-NR1-/-小鼠顯著恢復瞭對辣椒素的機械性痛敏。
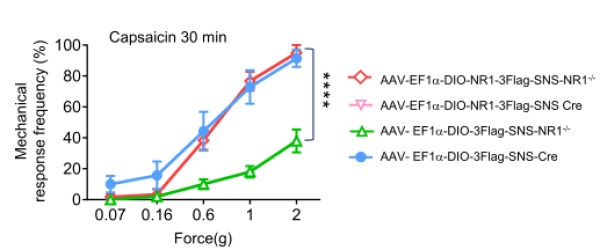
圖9傷害感受器末梢PreNMDARs參與傷害性超敏反應行為,過表達傷害性感受器NR1可恢復SNS-NR1-/-小鼠的痛覺超敏缺陷
綜上所述,實驗室提出傷害性感受器在調節初級傳入突觸傳遞和可塑性改變以及疼痛敏化中的機制假說,即傷害性感受器突觸前NMDARs(以下簡稱PreNMDARs)狀態依賴性地調控脊髓背角痛信息的傳入(圖10)。具體表現為:在生理狀態下PreNMDARs抑制脊髓背角突觸傳遞,而在炎癥誘致的病理狀態下則介導突觸傳遞增強。這種狀態依賴性的調節過程依賴於PreNMDARs介導的突觸前Ca2+內流。在生理狀態下,通過PreNMDAR介導的Ca2+內流激活SK通道,從而導致脊髓背角初級傳入突觸的突觸前抑制。相反,在病理狀態下,傷害感受器中樞突末梢上調的PreNMDARs導致Ca2+內流大量增加,並激活下遊級聯信號PKG-I,進而誘致BDNF產生和分泌增加,後者則抑制SK通道活性,導致SK通道功能下調,從而將突觸前抑制轉化為突觸前易化。病理狀態下,抑制傷害性感受器PreNMDARs可有效緩解慢性痛過敏。
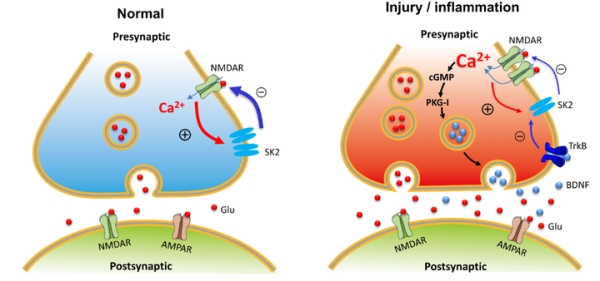
圖10機制圖
總之,該研究結果解析瞭脊髓背角傷害性感受器中樞突PreNMDARs在調節痛信息傳入的狀態依賴性特征,並揭示瞭一種潛在的狀態依賴性轉變的新機制和功能意義。即在生理狀態下,傷害性感受器PreNMDARs通過“突觸前抑制”的負反饋調控方式控制傳入痛信息量的多少,以維持機體的穩態平衡;而在病理狀態下,其則通過“突觸前易化”的正反饋調控方式不斷增強痛信息的傳入量,誘發突觸可塑性增強,從而導致痛信號的過度傳入進而加劇疼痛敏化的發生。
研究工作由空軍軍醫大學基礎醫學院神經生物學教研室完成,第一作者為解柔剛、褚文廣、劉大路和王旭,通訊作者為羅層教授和武勝昔教授。該文章得到瞭國傢自然科學基金、科技部重大項目計劃的資助。